2010 版 GMP 大大提高了无菌药品生产的控制要求。无菌原料药的生产很复杂。除环境清洁要求外,设备和管道的清洁和灭菌设计、材料、工具和内包装材料的转移也不同于制剂生产的要求。根据无菌原料药精制车间的设计经验,总结设计要点和主要经验供参考。
2010 版 GMP 大大提高了对无菌药物生产的控制要求,同时按 2010 版 GMP 实施要求,从2014年开始,所有无菌药物必须符合现行 GMP 的要求是生产。2012年至2013年,还完成了几个无菌原料药车间的设计改造项目,就像无菌制剂生产线的改造一样。
虽然无菌原料药验收由省、市局、国家局统一认证,但由于工艺和设备生产线相对成熟,无菌原料药生产相对复杂,除环境清洁要求外,设备和管道清洁灭菌设计、材料、工具和内包装材料转移不同于制剂生产要求。
结合已完成的项目设计经验和验收过程中检查员的重点和重点,总结一些要点与您讨论。
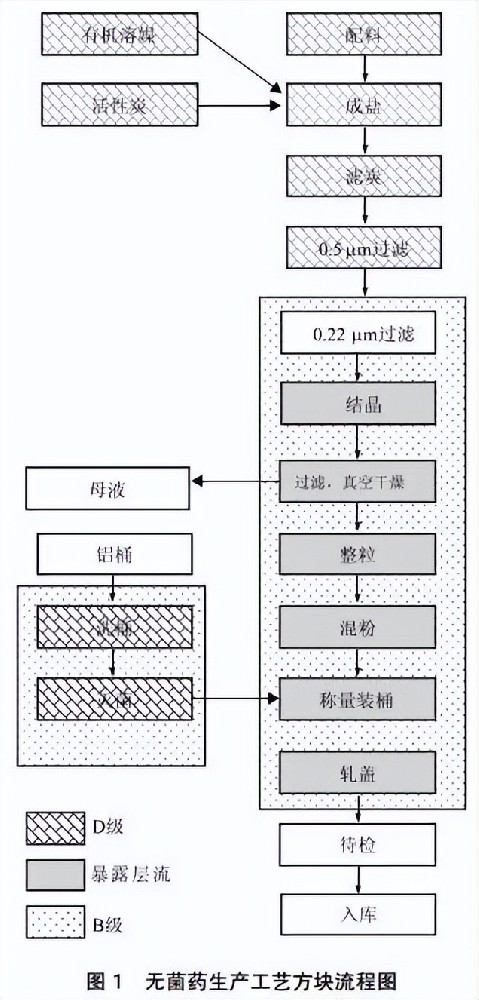
无菌原料药的主要工艺流程通常从最后一步溶解脱色反应开始,然后纯化精制、结晶过滤、干燥、混合(可选)、称重包装、标签存储。通常,生产过程如图 1 所示。
无尘车间设计要点
由于有机溶剂多用于反应和结晶段,无菌原料药精制净化车间布局通常分为防爆生产区和非防爆生产区,区域间按规范严格分隔。在无菌原料药精制车间的设计中,实施模块化设计理念,实现材料密封工艺系统,满足无菌原料药无菌生产的要求
根据无菌原料制剂车间生产工艺及布置的特点,生产工艺可分为以下模块:①反应与纯化区;②重结晶、过滤干燥区;③分装区;④其他。以下是设计要求和现场检查的一些注意事项。







 客服1
客服1